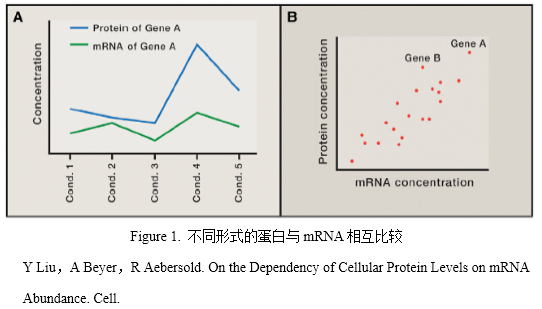
近20年来,高通量技术的发展支持了大规模的基因组、转录组和蛋白质组定量分析。这些数据被用来分析在不同系统和条件下转录组与蛋白质组的定量关系。这些研究有时候会导致一些冲突的结论,尤其是究竟在何种程度上mRNA的量控制了蛋白质的量。
基础生命科学研究和转化生命科学研究的一个核心问题是:基因组信息是如何通过自身的表达来决定表型的。中心法则将DNA、RNA和蛋白质这三种分子紧紧联系在了一起。来源于同一基因座的转录本的量与蛋白的量之间的关系并不简单。蛋白的表达水平除了被转录本的量调控以外,还存在其他许多重要的调控途径。这些途径包括(1)翻译率:翻译率受到mRNA序列的显著影响,比如上游的开放阅读框,内部的核糖体结合位点;(2)翻译率的调控:调控的方式有蛋白结合到转录本上的调控原件,非编码RNA的结合,转录本与核糖体的结合能力;(3)蛋白质的半衰期:泛素化途径的降解或者细胞自噬不依赖于转录本的量;(4)蛋白质合成的延迟:蛋白合成需要时间,因此转录的改变需要在一个短暂的延迟后才能影响蛋白的水平;(5)蛋白的转运:蛋白在空间上被转运出了它所合成的地方。因此,直接比较蛋白的丰度与mRNA的丰度是不可取的。
蛋白与mRNA的相互比较有两种不同的形式。一种是(Figure 1A)在不同的个体、条件或者时间点,比较来源于同一个基因的蛋白与mRNA的量,这样做是为了研究mRNA水平的变化在何种程度上影响了蛋白量的变化。另一种(Figure 1B)是比较多个不同的蛋白和与之对应的mRNA的量,这样做是为了研究在何种程度上蛋白水平能反应mRNA的不同。
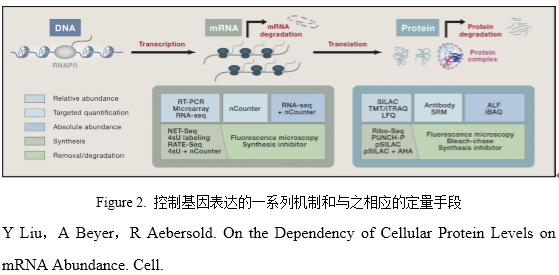
技术的进步加深了我们对mRNA与蛋白水平关系的理解。基因组层面的研究需要高精度、高灵敏度和高准确度的技术(Figure 2)。
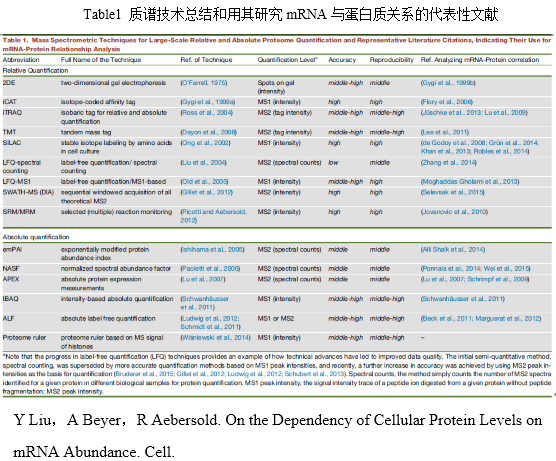
过去20年来,质谱技术已经成为研究蛋白定性和定量的重要方法。作为一种全面的工具,质谱支持大规模的相对和绝对定量(Table 1)。
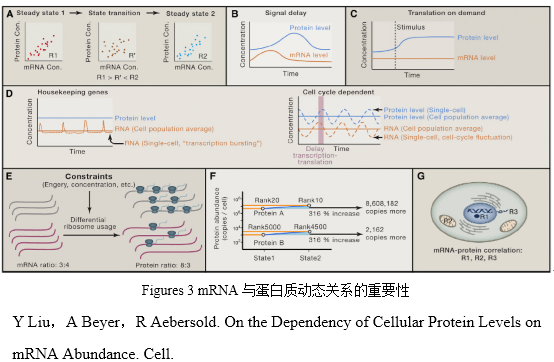
在稳定状态的时候,mRNA的水平决定了蛋白质的水平,而且蛋白质的合成会有延迟(Figures 3A and 3B)。很难严格地定义“稳定的状态”,姑且认为我们通常做组学实验时收集的细胞,如果在某个时间段内(通常几小时)的蛋白或者mRNA水平保持相对恒定,则被看做是 “稳定的状态”。
在短暂的适应期,转录后的调控非常重要。如果改变细胞的生存环境和条件,细胞需要短暂的适应期。这时如果仅仅只改变转录水平则太慢了,因此就需要转录后的调控机制。提高现有转录本的翻译速率能快速地合成新的所需蛋白,同时目标性地降解蛋白质,例如通过泛素途径,可以加速清除无用蛋白甚至毒性蛋白(Figures 3B–3D)。按需表达的机制可以保证在信号刺激时细胞快速地响应合成所需蛋白,而不是组成型地表达蛋白(Figures 3B)。另一方面,众所周知,翻译后修饰(也可以认为是一种转录后调控)在短暂适应期也非常重要。
由于能量和浓度的限制,细胞内蛋白的合成和降解是平衡的。蛋白合成受到多方面的限制。一方面是能量和营养;另一方面是催化蛋白合成的调节机制。合成蛋白的代价要比合成mRNA的代价大得多,因此细胞要选择最经济的办法来解决蛋白合成的问题。尽管处在各种限制下,细胞都努力使蛋白保持在恒定水平,无论稳态还是动态环境。这种物理的限制可以被用来优化蛋白的扩散速度、蛋白在细胞器间的转运和生化反应速率(Figures 3E–3G)。在细胞内,蛋白的拷贝数比mRNA的拷贝数多得多。一项研究表明,裂殖酵母在增殖期转换到平衡期时,mRNA的拷贝数减少了将近70%,而蛋白拷贝数只减少了9.5%。
蛋白质的合成需要细胞分配资源,这种分配由转录调控开始。细胞生产一种蛋白的代价主要由蛋白的前体,蛋白的组成(比如分子量)和蛋白合成速率决定。研究表明在细菌代谢途径中,合成高代价的酶通常受到多个转录速率调节;与之相反,合成低代价的酶仅受到几个关键反应的控制,通常这种通路都是组成型表达。因此,合成高代价的酶受到严格的调控以避免 “浪费”,低代价的酶即使它不被需要,依然可以被表达。转录调控反应了最小代价合成蛋白与最大化功能之间的平衡。研究表明,在一个特定的细胞周期,如果想激活或者失活某个蛋白复合体,不必合成或者降解这个复合体的每个成员,只需调节一些关键的成员就足够了。运用这种经济的原则,细胞用最小的代价调控了蛋白复合体。但是,在多细胞生物中,这种优化的机制可能不同。
细胞通过核糖体的使用来分配资源。细胞不得不灵活地利用翻译机器原件,比如翻译因子,tRNA,氨酰tRNA合成酶和核糖体。酵母蛋白翻译的主要限制可能是竞争游离的核糖体,而非竞争氨酰tRNA。
高丰度蛋白的绝对与相对量的调节。上调高丰度蛋白的倍数比上调低丰度蛋白的倍数,需要更多的拷贝数,因此代价要大得多。高丰度蛋白通常通过高mRNA绝对水平和高效地翻译产生。换言之,mRNA的量和翻译速率与蛋白丰度正相关。但是,高表达蛋白的生产速率貌似已经饱和,这种情况表明整体的翻译已成为大多数高丰度蛋白的限制。这种限制很可能由于mRNA上核糖体饱和引起。因此,那些高丰度蛋白通常只有最低的蛋白变化率,通常执行持家蛋白的功能。
另一方面,近期的研究表明蛋白合成速率的不同是决定蛋白拷贝数不同的主要因素(Figures 3F)。这种情况表明,mRNA的变化可以决定蛋白相对量的变化,转录后调控更多的导致蛋白绝对水平变化。因此,尽管翻译后调控可能显著地影响蛋白拷贝数,但是它可能不根本性地影响蛋白间的相对变化。
不同的空间,蛋白质与mRNA的关系不同。不同的空间,比如细胞群和组织与单细胞,单细胞与亚细胞单位,同样显著地决定了蛋白量究竟在何种程度上反映了转录本的量。在组织里如果不对细胞类型加以区分,会导致对蛋白质与mRNA的关系进行错误的评估。单细胞内蛋白质与相对应的mRNA的相关性会降低,整个细胞水平与亚细胞水平的相关性也不同。
总而言之,在稳定状态蛋白水平很大程度上由转录本的量决定;而在动态阶段,比如细胞分化或者应激,转录后的过程可能会导致更多的改变。在很多场景中仅仅只依据转录水平无法充分地预测蛋白水平。因此要解释清楚基因型与表型的关系,高质量多层次基因表达的数据对完整地理解生物学过程必不可少。蛋白质组学的发展为此提供了可能,iTRAQ、SILAC、SWATH等技术已广泛用于农业、工业、医学等行业的研究。
参考文献
Y Liu,A Beyer,R Aebersold. On the Dependency of Cellular Protein Levels on mRNA Abundance. Cell, 2016, 165(3):535-550
小编提醒:下一期,更多精彩与您分享,敬请期待!
如何低成本研究空间转录组?看完这篇文章你或许会有答案
(2022-06-02T14:51 浏览数:5723)
【周二晚八点】从位置到功能--空间转录组应用
(2022-05-16T08:59 浏览数:6528)
Cell Reports:利用空间转录组解析哺乳动物精子生成
(2022-04-28T14:54 浏览数:7690)
RNA二级结构调控基因表达的研究现状和进展
(2022-04-21T13:39 浏览数:5639)
Nature: MERFISH绘制小鼠初级运动皮层空间细胞图谱
(2022-04-18T13:24 浏览数:4448)
大自然的恩赐-外泌体药载
(2022-04-08T13:43 浏览数:5938)
【详解】基于图像的单细胞空间分辨转录组学技术
(2022-04-01T11:18 浏览数:9955)
知无不“研”,五分钟带你了解空间分辨转录组学的前世今生
(2022-03-18T14:00 浏览数:6756)
唾液外泌体与临床疾病的关联研究
(2022-03-11T16:36 浏览数:5225)
唾液外泌体与临床疾病的关联研究
(2022-03-11T16:36 浏览数:5747)